Model idealnog plina (jednadžba stanja) i difuzija
Svojstva idealnog plina:
a) čestice (atomi ili molekule) su zanemarivog volumena
b) međudjelovanje čestica je zanemarivo
c) sudari sa stjenkama su savršeno elastični
d) molekule plina se gibaju nasumično (

Idealni plin opisujemo jednadžbom stanja koja glasi:
Karakteristike idalnog plina su:
Množinu računamo kao omjer:
Prvi omjer je omjer broja molekula ili atoma plina \(N\) i Avogadrovog broja \(N_A = 6.022 \cdot 10^{23} \mathrm{mol^{-1}}\). Drugi omjer je omjer mase plina \(m\) i molarne mase \(M\).
Vezu između Boltzmannove konstante (\(k_B)\) i plinske konstante \(R\) možemo dobiti izjednačavanjem desnih strana jednadžbe stanja i poznavanjem formule za množinu, a ta veza je:
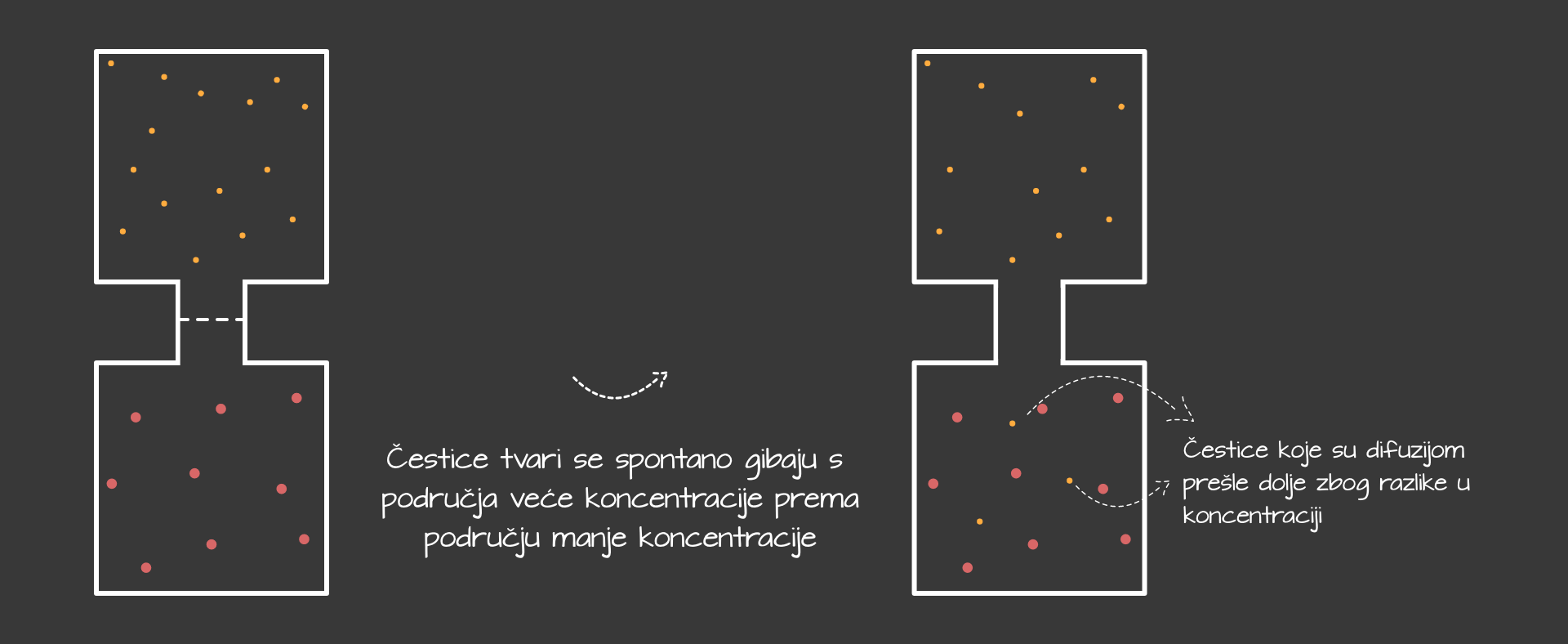
Difuzija
Zbog razlike u koncentracijama dolazi do mješanja dvaju tvari koje nazivamo